پتاسیم هیدروکسید (KOH) باز قوی و شناخته شده در صنعت است که اغلب با نام پتاس نیز شناخته میشود. این ماده شیمیایی واکنشهای زیادی با اسیدها و سایر مواد شیمیایی از خود نشان میدهد. یکی از این واکنشها که پایه و اساس واکنشهای شیمیایی این ماده با سایر مواد است، ترکیب پتاسیم هیدروکسید با آب نام دارد.
در شیمی حل شدن پتاسیم هیدروکسید در آب را تحت عنوان حلالیت پتاسیم هیدروکسید میشناسند. از این رو نمیتوان به فعل و انفعلاتی که بین آب و هیدروکسید پتاسیم رخ میدهد، نام واکنش شیمیایی گذاشت. دلیل این اتفاق به عدم بروز هر گونه تغییرات شیمیایی در فرایند انجام گرفته است. لذا ما با تغییرات فیزیکی سروکار داریم که در ادامه این نوشته از آوینا تجارت اطلس کاملتر به این موضوع پتاسیم هیدروکسید در اب خواهیم پرداخت.
پتاسیم هیدروکسید چیست؟
پتاسیم هیدروکسید با فرمول KOH جزو نمکهای بازی است که به صورت جامد پودری سفید رنگ به فروش میرسد. این ماده خاصیت بازی بالایی دارد و از همین رو در خنثی کردن اسیدها، تیتراسیونهای اسید-باز، تنظیم pH، حذف ناخالصی و یونهای مزاحم در محلولها به کار گرفته میشود. به عبارتی دیگر ما با ترکیبی روبهرو هستیم که در جای جای صنعت نقش دارد و این نقش از تولید مواد شوینده و تصفیه آب گرفته تا پالایش نفت و ساخت مواد شیمیایی برای کاربردهای متنوع، متغیر است.
هیدروکسید پتاسیم از جمله موادی است که میتواند به سرعت رطوبت هوا را جذب کند و با انحلال در آب، اتانول، گلیسرول و سایر محلولهای الکلی در فرایند واکنشهای شیمیایی شرکت کند. با توجه به این که KOH قلیای قوی است، لذا به راحتی در آب یونیزه شده و به یونهای تشکیل دهنده خود یعنی K+ و -OH تجزیه میشود. در ادامه توضیحات کاملتری در خصوص واکنش پتاسیم هیدروکسید با آب ارائه میدهیم و به نکات مهمی که در نتیجه این واکنش به دست میآوریم، اشاره میکنیم.
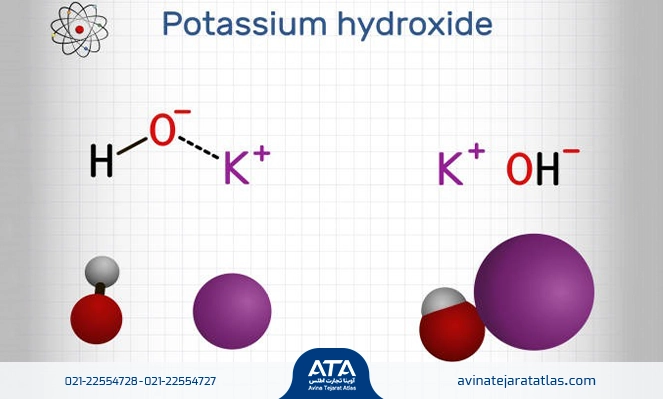
فرمول واکنش پتاسیم هیدروکسید با آب
پتاسیم هیدروکسید ترکیب یونی است که قابلیت تفکیک به اجزا سازنده خود یعنی یون پتاسیم K+ و یون هیدروکسید -OH را دارد. در اثر انحلال این ماده در آب بلافاصله پتاسیم هیدروکسید با ساختار باز قوی، به یون K+ و -OH تجزیه و تفکیک میشود. همین تفکیک شدن باعث افزایش pH آب میشود و در نهایت یونهای تفکیکی توسط مولکولهای آب احاطه میشوند. برای فهم بهتر این موضوع، معادله واکنش پتاسیم هیدروکسید با آب به همراه تصویر در ذیل آورده شده است:
KOH (l) + H2O (s) ” K+ (aq) + OH– (aq)
ترکیب پتاسیم هیدروکسید با آب چگونه انجام میشود؟
پتاسیم هیدروکسید نمک قلیایی با شکل ظاهری پودر سفید رنگ است که در نگاهی ساده و اولیه با حل شدن در آب، یونهای هیدروکسید و پتاسیم را از خود بر جای میگذارد؛ اما در بررسی مکانیسم و نحوه احاطه شدن یونهای پتاسیم و هیدروکسید توسط آب، فعل و انفعالات زیر رخ میدهد:
- در زمان اضافه شدن KOH به آب، بلافاصله مولکولهای آب به یونها نزدیک شده و به واسطه نیروی الکترواستاتیک قوی، یونهای تشکیل دهنده پتاسیم هیدروکسید از یکدیگر جدا میشوند. این اتفاق به دلیل ماهیت قطبی آب و ماهیت یونی پتاسیم هیدروکسید رخ میدهد.
- در همین حین یونهای K+ به دلیل برخورداری از بار مثبت، جذب بار جزئی منفی آب، یعنی بخش اکسیژن آب میشوند.
- از طرف دیگر یونهای -OH با بار منفی، جذب مولکولهای آب با بار جزئی مثبت میشوند و این گونه یونها را احاطه میکنند.
به این پدیده که در اثر احاطه شدن یونهای هیدروکسید پتاسیم توسط مولکولهای آب رخ میدهد، هیدراتاسیون میگویند که در نهایت خواص قلیایی محلول را افزایش میدهد.

دو حالت در نتیجه واکنش پتاسیم هیدروکسید با آب رخ میدهد:
- پس از حل شدن پتاسیم هیدروکسید در آب، pH محلول افزایش مییابد و محیط خنثی آب، قلیایی میشود.
- در اثر این انحلال گرما آزاد میشود و ظرف حاوی هیدروکسید پتاسیم و آب گرم میشود. این بدین معنی است که واکنش مذکور گرمازا است.
- واکنش پتاسیم هیدروکسید در آب و تفکیک شدن یونها باعث میشود تا محلولی قلیایی برای انجام برخی واکنشهای صنعتی داشته باشیم و به این ترتیب از نتیجه این انحلال به نفع شروع واکنشهای دیگر در صنایع استفاده کنیم.
نکات ایمنی و ملاحظات ترکیب پتاسیم هیدروکسید در آب
با توجه به گرمازا بودن واکنش پتاسیم هیدروکسید با آب، رعایت یک سری نکات ایمنی که در ادامه اشاره میکنیم، ضروری است:
- برای حفاظت از بدن، چشم و پوست در برابر پاشش احتمالی از واکنش گرمازای پتاسیم هیدروکسید در آب، حتما از دستکش، عینک ایمنی و لباس مناسب آزمایشگاهی استفاده کنید.
- در صورت تولید بخار، برای جلوگیری از استنشاق بخارات مضر، بلافاصله محل را ترک کنید
- در نظر داشته باشید که این واکنش باید زیر هود انجام گیرد تا هر گونه احتمال خطر برای دستگاه تنفسی کاهش پیدا کند.
- همواره پتاسیم هیدروکسید را به آب اضافه کنید. اضافه کردن عکس این کار، یعنی آب به پتاسیم هیدروکسید، خطر پاشش و واکنشهای ناگهانی را با خود به همراه دارد.
- هیدروکسید پتاسیم را در محیطی خشک و خنک و در ظروف مقاوم به مواد شیمیایی بازی نگهداری کنید.
- در صورت تماس محلول با چشم، فورا آن را با آب شستوشو دهید و در صورت ادامهدار بودن سوزش به پزشک مراجعه کنید.
- با توجه به گرمازا بودن واکنش، محلول را با سرعت بالا هم نزنید. این کار ممکن است باعث بروز خطرات و واکنشهای دیگری از سوی محلول شود.
اهمیت محلول آبی پتاسیم هیدروکسید در صنعت
ترکیب پتاسیم هیدروکسید با اب به خاطر ویژگیهای قلیایی، تنظیم کننده pH، ساختار نمکی و واکنش پذیری بالا با اسیدها و برخی مواد شیمیایی، کاربردهای گستردهای در صنعت تصفیه آب، محصولات مراقبتی و بهداشتی، نفت و گاز، مواد غذایی، داروسازی و غیره از خود نشان میدهد.
اهمیت محلول آبی پتاسیم هیدروکسید را میتوان در قابلیت خنثی کردن اسیدهای موجود در آب، حذف یونهای مزاحم از آب، تصفیه ناخالصیها در مواد غذایی، کاتالیزور در پیشبرد برخی فرایندهای شیمیایی، جلوگیری از خوردگی فلزات و غیره مشاهده کرد. از این رو تهیه این ماده با کیفیت درجه یک بسیار حائز اهمیت است و باید این ماده شیمیایی را همانند سایر ترکیبات از فروشگاهی معتبر تهیه کرد. در صورتی که نیاز به راهنمایی برای تهیه پتاسیم هیدروکسید صنعتی دارید، میتوانید با کارشناسان ما در آوینا تجارت اطلس در تماس باشید.


